Portal del Medicamento
Esta tabla incluye el cuerpo de datos relativo al portal, es decir información relativa a contenidos, mapa web, etc. en función de la página en la que se encuentre el usuario.
La notificación de las reacciones adversas a medicamentos (RAM) es uno de los procedimientos más eficientes para conocer los problemas que ocurren con los fármacos una vez que se comercializan y son utilizados por un gran número de pacientes en condiciones reales. En España, la información que se ha generado a través de la notificación espontánea ha dado lugar a distintas medidas reguladoras que están contribuyendo a que la oferta de medicamentos sea más segura y la prescripción, en consecuencia, de mejor calidad.
¿Quién debe notificar? (RD 577/2013)
- los profesionales sanitarios (médicos, farmacéuticos, enfermeros, odontólogos y demás profesionales sanitarios) están obligados a notificar las sospechas de reacciones adversas a medicamentos
- los ciudadanos podrán notificar las sospechas de reacciones adversas a medicamentos a través del portal www.notificaram.es.
- los laboratorios titulares de autorización del fármaco están obligados a notificar las sospechas de reacciones adversas GRAVES de las cuales tengan conocimiento.
¿Qué se debe notificar?
- Se debe notificar toda reacción adversa que se sospeche que ha sido causada por un medicamento (medicamentos convencionales con y sin receta, fórmulas magistrales, preparados oficinales, vacunas, medicamentos homeopáticos, plantas medicinales), prescrito o no por el médico notificador. Hay que tener en cuenta que también se debe notificar sospechas de reacciones adversas que surgen como resultado del error de uso, mal uso, abuso o usos fuera de las indicaciones terapéuticas autorizadas en la ficha técnica del medicamento.
- Se priorizará la notificación de reacciones adversas graves, inesperadas, de medicamentos sometidos a seguimiento adicional (
 ) y aquellas ocurridas en poblaciones especiales (ej. niños, embarazadas,...)
) y aquellas ocurridas en poblaciones especiales (ej. niños, embarazadas,...)
- No hay que demorarse en notificar, incluso si aún no se tiene la certeza de su causalidad.
- Si no se está seguro de si se debe notificar, se recomienda notificar de igual modo.
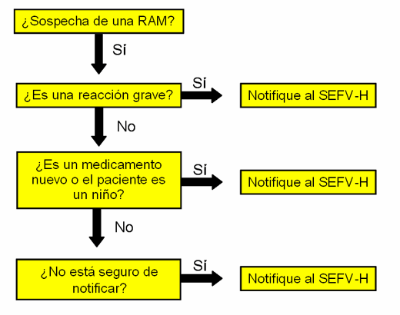
Fuente: Información para las notificaciones de sospechas de reacciones adversas a medicamentos por parte de profesionales sanitarios . AEMPS.
. AEMPS.
¿Cómo notificar?
El formulario oficial para la notificación de sospechas de reacciones adversas a medicamentos es la Tarjeta Amarilla. Este formulario permite recoger los datos necesarios para evaluar una posible relación de causalidad entre un medicamento y una reacción adversa. Es importante incluir toda la información posible sobre el caso. No obstante, es suficiente con completar los datos mínimos necesarios: un paciente identificable, uno o varios fármacos sospechosos, una o varias reacciones adversas y un notificador identificable.
Cualquier información relacionada con el paciente o notificador se tratará como confidencial.
Posibilidades de notificación
- Tarjeta amarilla en papel: Se rellena la tarjeta amarilla y se envía al Centro de Farmacovigilancia de Castilla y León por correo postal. La tarjeta amarilla viene con la dirección impresa y tiene franqueo en destino.
 Imagen en alta resolución. Este enlace se abrirá mediante lightbox, puede haber un cambio de contexto Imagen en alta resolución. Este enlace se abrirá mediante lightbox, puede haber un cambio de contexto |
Centro de Farmacovigilancia de Castilla y León Facultad de Medicina Avda. Ramón y Cajal, 7 47005 Valladolid. Tfn: 983263021 / Fax: 983254924 farmacovigilancia@ife.uva.es |
| (Si se no dispone de tarjetas amarillas, se pueden solicitar al Centro por teléfono, fax o correo electrónico) | |
- Por teléfono: llamando directamente al Centro de Farmacovigilancia de Castilla y León.
- Formulario electrónico: Formulario de notificación espontánea del Sistema Español de Farmacovigilancia, disponible en www.notificaRAM.es
 . En primer lugar se debe seleccionar la Comunidad Autónoma, después se completa el formulario y este se envía on-line al Centro de Farmacovigilancia de la comunidad seleccionada.
. En primer lugar se debe seleccionar la Comunidad Autónoma, después se completa el formulario y este se envía on-line al Centro de Farmacovigilancia de la comunidad seleccionada.
Existen diferentes vías para acceder a este formulario de notificación on-line:
1. Pasos para notificar a través de la HISTORIA CLÍNICA ELECTRÓNICA DE ATENCION PRIMARIA (MEDORA)
El acceso se encuentra dentro de la carpeta Alergias-Int (Alergias/Intolerancias) que ofrece el visor clínico, tanto desde la pantalla principal como desde la pantalla de prescripción:
|
PANTALLA PRINCIPAL |
PANTALLA PRESCRIPCIÓN |
|
Dentro de la pantalla de "Alergias e intolerancias" bastará con seleccionar el epígrafe "Notificación de reacciones adversas a medicamentos (RAM)": |
|
2. Pasos para notificar a través del NUEVO MÓDULO DE PRESCRIPCIÓN
El nuevo Módulo de prescripción es externo a Medora y su acceso al mismo se realiza a través de:
- MEDORA (Historia clínica electrónica de Atención Primaria)
- JIMENA (Historia clínica electrónica de Atención Especializada)
|
En la última línea de la pantalla del plan terapéutico se encuentra el botón "‘Notificación RAM" que dirige a la web indicada: |
3. Pasos para notificar a través del PORTAL DEL MEDICAMENTO
|
Desde la portada, a través del apartado Boletines de Seguridad > Centro de Farmacovigilancia > Notifica una reacción adversa |
A través del menú Enlaces > Farmacovigilancia |
TABLA RESUMEN DE NOTIFICACIÓN DE RAM
Comentario elaborado por Belén Concejo Alfaro1, Mª Isabel Jiménez Serranía1 y María Sáinz Gil2.
1Dirección Técnica de Farmacia; 2 Centro de Farmacovigilancia de Castilla y León.

