Portal del Medicamento
Esta tabla incluye el cuerpo de datos relativo al portal, es decir información relativa a contenidos, mapa web, etc. en función de la página en la que se encuentre el usuario.
La Agencia Europea del Medicamento aprobó 3 nuevos biosimilares en 2018 y otros 10 en 2017, de esta manera ya son más de 40 los que cuentan con autorización para su comercialización en los países de la Unión Europea.
El uso de biosimilares cada vez es más frecuente, sin embargo este incremento es variable entre las comunidades autónomas. Existen notables diferencias en las medidas adoptadas por los sistemas de salud autonómicos que dan lugar a diferencias en su grado de utilización.
Cada vez hay más estudios que avalan el switching (cambio) a medicamentos biosimilares y que ponen de manifiesto su eficacia y seguridad en condiciones de práctica clínica (ver revisión publicada en Drugs, 2018 ). Esto, sumado a la labor formativa que se ha realizado desde la AEMPS, las CCAA y los centros hospitalarios, ha aumentado la confianza de los profesionales en los biosimilares y, por consiguiente, su utilización (ver resultados de la encuesta realizada en CyL, 2018).
). Esto, sumado a la labor formativa que se ha realizado desde la AEMPS, las CCAA y los centros hospitalarios, ha aumentado la confianza de los profesionales en los biosimilares y, por consiguiente, su utilización (ver resultados de la encuesta realizada en CyL, 2018).
En 2018, se ha incrementado el consumo de biosimilares, pero todavía queda mucho camino por recorrer. Los últimos datos de utilización de medicamentos biosimilares en Castilla y León son los siguientes:
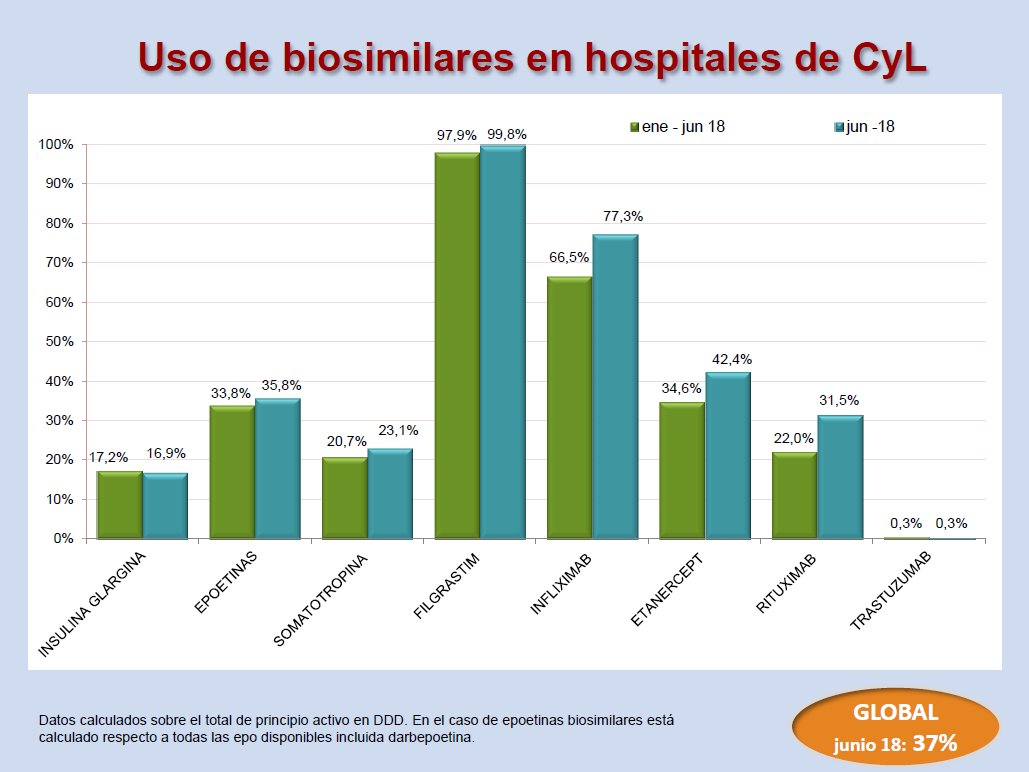
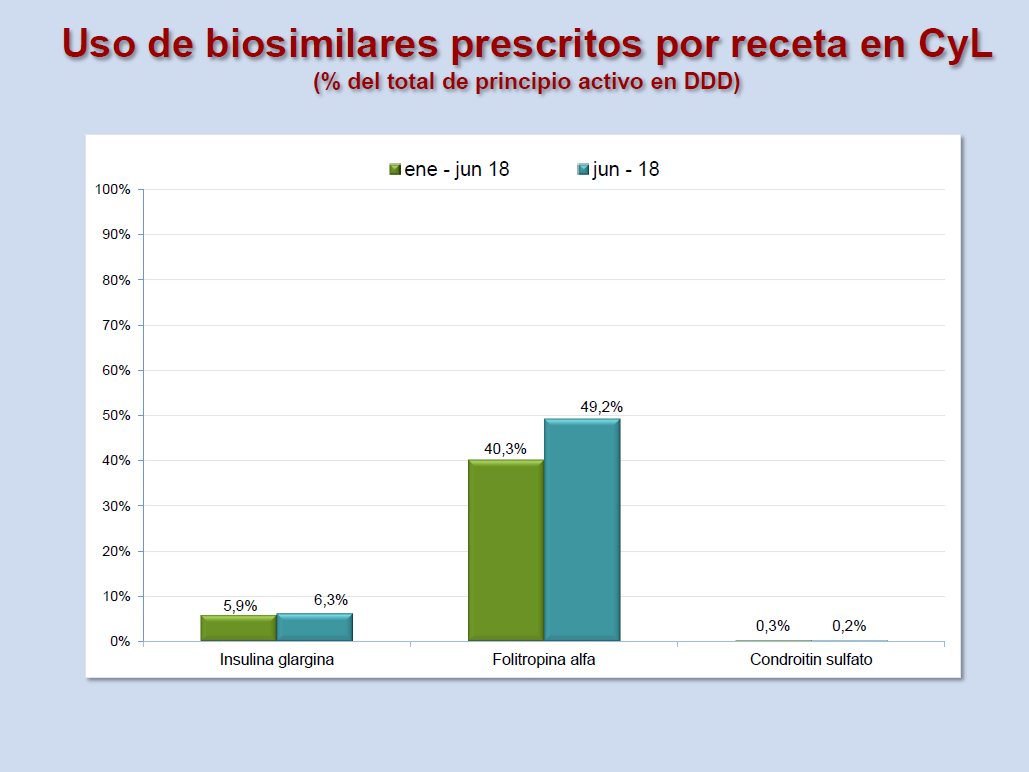
En la sección de medicamentos biosimilares de este portal se pueden consultar los informes de consumo publicados hasta ahora.

