Portal del Medicamento
Esta tabla incluye el cuerpo de datos relativo al portal, es decir información relativa a contenidos, mapa web, etc. en función de la página en la que se encuentre el usuario.
Vía adaptada: acceso a innovación o postverdad
Ojo de Markov número sesenta y uno - mayo 2017
El desarrollo de un nuevo medicamento
Las fases que comprende el desarrollo de un nuevo medicamento están muy definidas y reguladas. Se distingue una fase preclínica, una fase clínica y una fase post-comercialización. Cada fase aporta información sobre el nuevo fármaco.
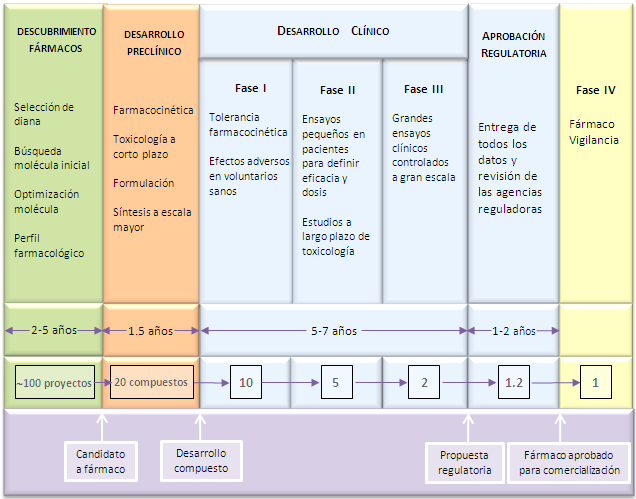
Imagen tomada y modificada de Rang and Dale's Pharmacology-sixth edition
Otras formas de desarrollo de nuevos fármacos
La legislación farmacéutica de la UE contiene normas para la autorización y supervisión de los medicamentos de uso humano. La industria, algunas asociaciones de pacientes, grupos de presión e inversionistas afirman que el modelo actual de desarrollo y regulación de fármacos es insostenible y han solicitado un "cambio de paradigma" para que se apruebe un mayor número de nuevos fármacos basándose en datos preliminares, de manera que la información clave sobre beneficios y riesgos sea recogida después de la puesta en el mercado de estos medicamentos.
Desde 2006 la Agencia Europea del Medicamento (EMA) tiene establecida la posibilidad de una autorización de comercialización de medicamentos más temprana, con datos menos exhaustivos, mediante la autorización de comercialización condicionada o autorización en «circunstancias excepcionales». Por otra parte en 2012 se apostó por una farmacovigilancia más proactiva , promoviendo la realización de estudios postautorización y la utilización de las bases de datos de registros de pacientes. Estas dos condiciones han sido fundamentales para abordar la llamada Vía Adaptada que la EMA
, promoviendo la realización de estudios postautorización y la utilización de las bases de datos de registros de pacientes. Estas dos condiciones han sido fundamentales para abordar la llamada Vía Adaptada que la EMA propone en 2014 y sobre la que realiza un pilotaje cuyos resultados publica en 2016.
propone en 2014 y sobre la que realiza un pilotaje cuyos resultados publica en 2016.
¿En qué consiste la Vía adaptada?
La vía adaptada solo se aplicaría a medicamentos dirigidos a pacientes con necesidades médicas insatisfechas o no cubiertas. Los fármacos aprobados a través de esta vía recibirían una autorización de comercialización escalonada, antes que en el proceso habitual, a partir de datos preliminares. Se aprobarían fármacos ensayados en pequeños grupos de pacientes altamente seleccionados, la autorización estaría restringida a pacientes en los que hubiera mayor probabilidad de beneficiarse del tratamiento; se podría conseguir con datos de menos ensayos clínicos, ensayos más pequeños, a corto plazo y con variables subrogadas en lugar de variables de relevancia clínica. También sería posible evitar los ensayos en fase III y obtener la autorización de comercialización una vez finalizados los estudios de fase II de un solo brazo. El desarrollo del producto continuaría después de que hubiera llegado al mercado y estuviera siendo utilizado por los pacientes.
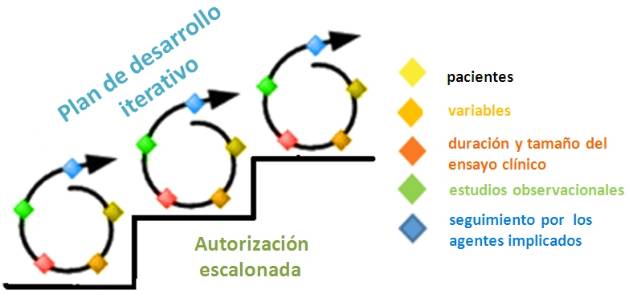
La vía adaptada exige:
-
Un plan de desarrollo iterativo, planeado prospectivamente. Esto significa que la evidencia se adquiriría paso a paso, mediante la recopilación de datos después de la autorización, bien para que la indicación inicial, restringida y limitada a un grupo de pacientes, se extendiera a una población más amplia o para confirmar el equilibrio beneficio-riesgo del nuevo fármaco aprobado en una fase temprana de desarrollo o sobre la base de una variable subrogada.
-
La colaboración de los principales interesados en el proceso: agencias de evaluación o reguladoras, profesionales sanitarios y pacientes. Se realizaría un seguimiento y control de la prescripción en los pacientes seleccionados, valoración de los resultados iniciales de las variables y de los riesgos asociados.
-
La realización de estudios observacionales con las bases de datos clínicas que proporcionen evidencia en condiciones reales, diseñados para recopilar datos de alta calidad, para afinar el perfil beneficio/riesgo, el valor terapéutico y el precio de un medicamento.
Críticas a la vía adaptada
Un grupo de autores pertenecientes a centros de evaluación de medicamentos y de análisis de la evidencia son muy críticos con esta vía de autorización. En un artículo del BMJ recogen sus dudas y señalan las debilidades de este procedimiento. También expresan sus temores sobre la influencia que esta vía podría tener en la disminución en la exigencia de los criterios actuales de autorización.
recogen sus dudas y señalan las debilidades de este procedimiento. También expresan sus temores sobre la influencia que esta vía podría tener en la disminución en la exigencia de los criterios actuales de autorización.
Algunas de estas cuestiones se resumen a continuación:
Selección de los medicamentos: La autorización de comercialización condicional que permite la aprobación en una fase temprana y que se reserva para los medicamentos dirigidos a enfermedades potencialmente mortales, enfermedades huérfanas o situaciones de emergencia, no puede convertirse en una nueva manera de conseguir la autorización de fármacos que deberían seguir los cauces habituales.
Calidad de la evidencia: La vía adaptada asume que con datos preliminares puede estimarse un beneficio/riesgo del nuevo medicamento favorable para algunos pacientes. Sin embargo la experiencia acumulada cuestiona la calidad de la evidencia que se puede obtener de estos datos:
-
La mitad los fármacos en investigación que completan con éxito los estudios de fase II fracasan en la fase III, principalmente debido a la falta de seguridad o eficacia.
-
Los ensayos más pequeños, de corto plazo o individuales, son más propensos a sobreestimar o generar efectos espurios del tratamiento.
-
La evaluación de las variables subrogadas demuestran que los resultados son a menudo sesgados, pueden sobreestimar los beneficios de los fármacos y se correlacionan mal con los resultados relevantes para los pacientes.
Estudios observacionales y bases de datos
-
Es necesario avanzar en la metodología y validación de las bases de datos antes de considerarlas una fuente fiable para evaluar seguridad.
-
También es problemática la utilización de estos datos para evaluar eficacia.
-
La finalización de los estudios confirmatorios y posteriores a la comercialización dura alrededor de cuatro años y, con frecuencia, se completan con retraso.
La restricción de uso y su posible reversión posterior a la comercialización: el proceso iterativo
-
Cuando un medicamento es "proclamado" como una novedad o un avance que merece una vía excepcional, se considera poco realista pensar que su prescripción se puede limitar a un restringido grupo de pacientes.
-
Adaptar la prescripción a los nuevos datos que surjan una vez que el fármaco está en el mercado, no es tan sencillo. La experiencia indica que es difícil cambiar hábitos de prescripción inútiles o inseguros y que los mecanismos de control actuales para evitar reacciones adversas no siempre funcionan.
-
Además, los nuevos datos que proporcionen evidencia pueden surgir poco a poco y, como ya sucede, es posible que sean discutidos u objeto de polémica, especialmente cuando el beneficio económico sea alto, los conflictos abunden y la reputación de los profesionales, y a veces de una especialidad médica entera, pudiera estar en juego.
El Consejo Europeo en julio de 2016 , reconoce que
, reconoce que
Las condiciones precisas para la inclusión de medicamentos innovadores y especializados en los marcos de autorización de comercialización temprana existentes, podrían aclararse más con el fin de mejorar la transparencia, garantizar una relación beneficio-riesgo positiva y continua de los medicamentos comercializados en condiciones especiales y con el fin de centrarse en los medicamentos con un importante interés terapéutico para la salud pública o para satisfacer las necesidades médicas de los pacientes que no están cubiertas.
Elaborado por: Alejandra García Ortiz
Maquetación, imágenes y revisión de texto: Beatriz T. Jiménez Arribas

