Portal del Medicamento
Esta tabla incluye el cuerpo de datos relativo al portal, es decir información relativa a contenidos, mapa web, etc. en función de la página en la que se encuentre el usuario.
Siempre que se produzcan modificaciones en el proceso de fabricación de cualquier medicamento biológico, sea o no biosimilar, hay que realizar estudios de comparabilidad que aseguren que el producto obtenido tras la modificación es similar al que se obtenía antes. Sin embargo, con frecuencia, los estudios de comparabilidad se asocian solo con los medicamentos biosimilares.
El objetivo de la encuesta sobre medicamentos biológicos/biosimilares ha sido informar y analizar el conocimiento de los prescriptores sobre los cambios en el proceso de fabricación de estos medicamentos, así como difundir la normativa regulatoria de la EMA sobre el ejercicio de comparabilidad, aspectos a evaluar y consideraciones en cada caso (si es un medicamento biosimilar o si es un cambio en el proceso de fabricación).
Un total de 59 profesionales han respondido a la encuesta (21 hematólogos, 14 digestivos, 10 reumatólogos, 5 dermatólogos y 9 de otras especialidades).
Un 53% han prescrito solo uno de los siguientes medicamentos: adalimumab, abatacept, certolizumab, epoetinas, etanercept, filgrastim, golimumab, infliximab, rituximab, tocilizumab y somatropina y un 47% varios de ellos. Los medicamentos prescritos con mayor frecuencia han sido adalimumab y rituximab, seguidos de infliximab y filgrastim.
En cuanto a los cambios en el proceso de fabricación de medicamentos biológicos/biotecnológicos, el 66% sabía que se producían pero no el número y frecuencia de los mismos (a); el 17% desconocía la existencia de estos cambios (b) y otro 17% los conocía en detalle (c).
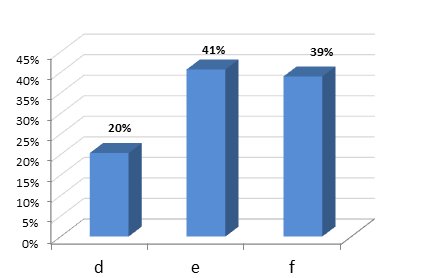
Respecto a la obligatoriedad de realizar el ejercicio de comparabilidad cuando se producen modificaciones en el proceso de fabricación, el 20% de los profesionales pensaban que los estudios de comparabilidad afectaban únicamente a los medicamentos biosimilares (d); el 41% ya era consciente de que esta obligación afecta a cualquier medicamento biológico, sea o no biosimilar (e) y el 39% desconocía esta normativa de la Agencia Europea del Medicamento (EMA) (f).
A la pregunta sobre si conocían en qué consisten los estudios de comparabilidad, el 34% afirman estar informados sobre los aspectos que hay que evaluar en el ejercicio de comparabilidad (g), el 47% conocían en qué consisten estos estudios pero no en detalle (h) y el 19% respondieron que desconocían esta información (i).
Por último, en cuanto a la información recibida, 36 encuestados la han considerado de utilidad de cara a la práctica clínica; a 22 les ha parecido útil, aunque secundaria desde el punto de vista clínico y un profesional ha respondido que carece de utilidad.
Conclusiones
- El conocimiento de los profesionales sobre los cambios en el proceso de fabricación de medicamentos biológicos/biosimilares cada vez es mayor. Sin embargo, la regulación y detalle de los aspectos que hay que evaluar en el ejercicio de comparabilidad es poco conocida.
- La información proporcionada ha sido valorada positivamente por casi la totalidad de los encuestados. Esto puede suponer un aumento de la confianza en los medicamentos biosimilares y, por consiguiente, su utilización.
Comentario elaborado por Belén Calabozo
Informes técnicos de utilización de medicamentos

